
以下文章来源于bioart ,作者十一月
阿尔茨海默病的特征是淀粉样蛋白早期沉积,随后是病理性tau蛋白的累积。越来越多的研究表明,肠道微生物的扰动可能与淀粉样蛋白的沉积之间存在联系,这一过程可能通过影响神经炎症和代谢稳态而导致【1-3】。但是肠道菌群对于tau介导神经退行性病变的贡献还尚未可知。另外,最近的研究发现肠道微生物菌群的结构受到载脂蛋白apoe的不同影响,apoe是阿尔茨海默病的重要遗传风险因素,也是tau蛋白介导的神经退行性病变的已知调节因子【4-5】。为了揭开肠道微生物菌群调节神经退行性疾病的机制,美国华盛顿大学医学院david m. holtzman研究组在science发文题为apoe isoform- and microbiota-dependent progression of neurodegeneration in a mouse model of tauopathy,揭示了肠道微生物菌群、神经炎症以及tau蛋白介导的神经退行性病变之间的相互关系。

作者们希望检测肠道微生物菌群以apoe依赖的方式调节tau病理和tau介导的神经退行性病变的可能性。为此,作者们所依托的实验模型是表达人类不同apoe亚型apoe3和apoe4的tau蛋白病理性小鼠模型,分别被称为te3和te4。为了对小鼠中微生物肠道菌群进行操纵,作者们分别在无菌条件以及生命早期的进行早期抗生素治疗。小鼠的饲养是标准的小鼠饲料,到40周龄的时候进行安乐死,此时小鼠通常会有严重的脑萎缩。
作者们对第一组te4小鼠进行无菌培养;第二组的te4小鼠在出生时就暴露在微生物中,常规饲养的小鼠随后在指定的无病原体条件下饲养;第三组小鼠在无菌条件下饲养至12周龄,此时给它们进行40周龄常规死亡的小鼠粪便微生物群的口服灌胃。所有的小鼠都给予富含植物多糖的标准动物饲料。作者们发现常规培养的雄性te4小鼠表现出更严重的神经退行性特征,严重的局部脑萎缩、海马体积减少和侧脑室增加(图1)。因此,肠道微生物菌群在很大程度上影响了tau介导的神经退行性病变的后期出现。
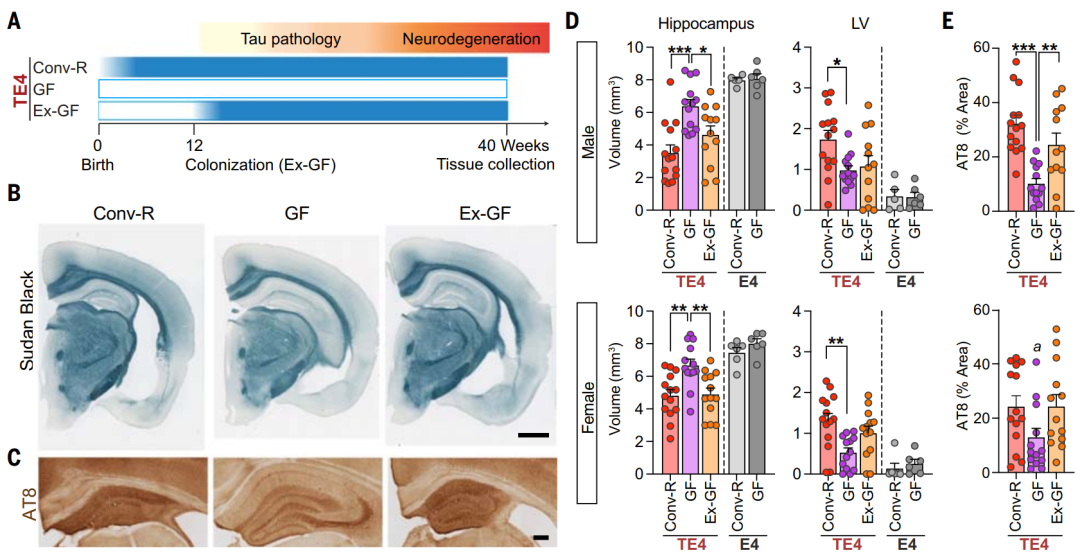
图1 无菌条件下培养的te4小鼠具有抵抗tau蛋白介导的神经退行性病变的能力
最近有研究表明,小胶质细胞和星形胶质细胞是tau介导的神经退行性病变所必须的【6】。因此,作者们假设肠道微生物菌群可能是通过改变神经胶质细胞的反应来调节tau蛋白介导的神经变性的。为此,作者们对小胶质细胞和星形胶质细胞中胶质纤维酸性蛋白gfap等进行标记,发现与常规培养的雄性小鼠相比,无菌培养的小鼠海马区中所有的这些胶质标记物的表达会出现显著的降低。另外,无菌培养的小鼠星形胶质细胞尺寸更大,分支突起也更多,说明功能的完整性。因此,无菌培养条件影响与tau介导的神经退行性病变相关的小胶质细胞和星形胶质细胞的反应性或激活。
为了测试肠道菌群是否以apoe亚型依赖的方式调节tau介导的神经退行性病变,作者们使用抗生素鸡尾酒abx对常规培养的te4小鼠、te3小鼠以及无apoe的小鼠进行治疗。短期的抗生素鸡尾酒疗法会导致活菌总数立即显著减少。abx治疗并不会影响脑容量或者tau蛋白病理性特征。在40周龄的时候,abx的治疗会降低磷酸化的tau蛋白水平。因此,抗生素诱导的肠道菌群扰动可防止tau介导的神经退行性病变。
通过对海马组织进行单细胞核rna-seq,作者们分别比较了抗生素处理和未处理的脑组织,发现抗生素的处理会显著改变小胶质细胞和星形胶质细胞中的基因表达以及形态响应。另外,作者们发现abx所诱导的微生物群扰动在雄性te3小鼠中对tau介导的神经退行性病变的保护作用最强。而这一抗生素处理过程主要重塑了肠道微生物菌群中的短链脂肪酸以及会影响周围免疫反应。

图2 工作模型
总的来说,作者们的工作发现揭示了微生物群、免疫反应和tau蛋白介导的神经退行性病变之间的相互关系以及作用机制(图2)。该工作为进一步探索阿尔茨海默病以及tau蛋白病的预防和治疗提供了新的途径。

同期刊发了观点文章对该工作进行介绍,题为gut microbes modulate neurodegeneration,该工作发现了小鼠中微生物群以遗传和性别特异性的方式介导了神经炎症,最终导致神经退行性疾病的进展。抗生素鸡尾酒疗法可能会成为降低tau蛋白病变的可能治疗手段之一。
原文链接:https://doi.org/10.1126/science.add1236
参考文献


